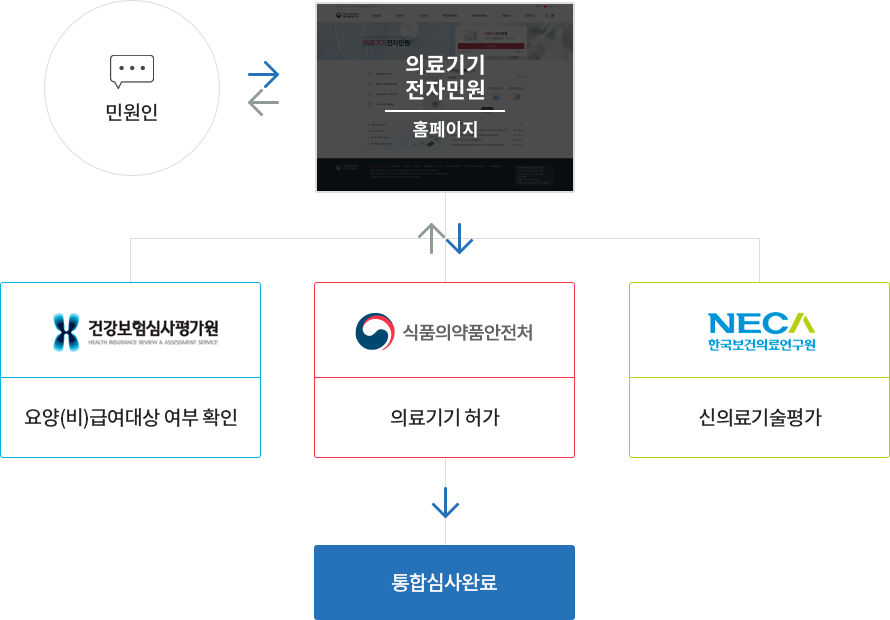
통합운영 민원안내 입니다.
✓ ‘의료기기 허가·신의료기술평가 등 통합운영’은 (식품의약품안전처)의료기기 허가, (건강보험심사평가원)요양급여대상·비급여대상 여부 확인,
(한국보건의료연구원)신의료기술평가를
의료기기 전자민원에서 함께 신청하여 동시 심사를 진행하는 제도입니다.
✓ 통합운영 제도를 이용하면 기관별 협업 및 동시 심사를 통해 의료기기 시장진입 시간을 단축할 수 있습니다.
-
질문내용 :통합운영 민원신청은 어떻게 하나요?
답변내용 :
민원신청은 회원 로그인 후에 민원신청이 가능합니다.
-
질문내용 :통합운영 민원신청 대상은 무엇인가요?
답변내용 :
다음의 민원 중 의료기기의 사용목적이 의료기술의 사용목적을 포괄하거나, 두 사용목적이 일치하는 경우
- - 의료기기제조허가(기술문서심사)
- - 의료기기제조허가(임상자료심사)
- - 의료기기제조허가변경(기술문서심사)
- - 의료기기제조허가변경(임상자료심사)
- - 의료기기수입허가(기술문서심사)
- - 의료기기수입허가(임상자료심사)
- - 의료기기수입허가변경(기술문서심사)
- - 의료기기수입허가변경(임상자료심사)
-
질문내용 :통합운영과 원스탑서비스의 차이점은 무엇인가요?
답변내용 :
원스탑서비스는 의료기기 허가가 완료되지 않아도 민원인이 요양급여대상·비급여대상 여부확인, 신의료기술평가를 각 기관에 개별적으로 신청할 수 있습니다. 다만, 각 기관(식품의약품안전처, 건강보험심사평가원, 한국보건의료연구원)간 정보공유 및 의견교환 없이 독립적으로 심사가 진행됩니다.
통합운영은 의료기기 허가 신청 시 요양급여대상·비급여대상 여부확인, 신의료기술평가를 함께 신청하여 동시 진행할 수 있습니다. 또한, 각 기관(식품의약품안전처, 건강보험심사평가원, 한국보건의료연구원) 간 정보공유 및 의견교환이 가능합니다.
-
질문내용 :통합운영 통합 민원상담은 무엇인가요?
답변내용 :
통합운영을 신청한 민원인과 식품의약품안전처, 건강보험심사평가원, 한국보건의료연구원 담당자가 영상회의시스템을 통해 통합 민원상담을 할 수 있습니다.
통합 민원상담 신청은 다음과 같습니다.
- - 통합심사운영팀에 유선으로 민원상담 신청(043-719-3772)
- - 온나라 PC영상회의사이트(http://vc.on-nara.go.kr)에 접속하여 문자로 전송받은 코드번호 입력
- - 영상회의 참여
인터넷, 카메라, 헤드셋이 구비된 환경 어디에서나 상담이 가능하며, 관련 장비가 없을 경우 식약처 민원상담실에서 진행됩니다.
-
질문내용 :각 기관의 통합운영 민원의 심사일정은 어떻게 확인하나요?
답변내용 :민원신청>나의민원>민원신청내역>통합운영 잔향상황 클릭 시 각 기관의 민원진행현황, 담당자명, 담당자 연락처, 처리기한을 확인할 수 있습니다.
- 질문내용 :관련 자료 확인
-
질문내용 :기관 대표 전화번호
답변내용 :
기관명 전화번호 식품의약품안전처 1644-0222 한국보건의료연구원 02-2174-2809/2729 건강보험심사평가원 1644-2000 ※ 시스템적인 문제가 발생 할 경우에는 식품의약품안전처로 문의를 주세요.
※ 업무내용은 위의 전화번호를 참고하여 각 기관에 문의 할 수 있습니다.









