디지털의료기기 GMP 심사
업무소개
「디지털의료제품법」 제48조 및 동 법 시행령 제7조제1항제1호에 따라 디지털의료기기 적합판정 등 업무를 인증업무등 대행기관(한국의료기기안전정보원)에서 2025년 1월 24일부터 수행하고 있음
주요사업
- 디지털의료기기 제조 및 품질관리기준 적합판정 등 심사
- 디지털의료기기 적합판정서 발급 및 재교부
대상 제품
← 좌우 스크롤이 가능합니다. →
| 의무사항 | 자율사항 |
|---|---|
| 1. 독립형 디지털의료기기소프트웨어 | 4. 수출용 디지털의료기기 |
| 2. 내장형 디지털의료기기소프트웨어 | 5. 1등급 디지털의료기기 |
| 3. (임상시험용)의료기기 하드웨어 |
유형군
인공지능 및 머신러닝(AI/ML) 기능 탑재 여부 등 제품 특성을 반영하여 「디지털의료기기 제조 및 품질관리 기준」 에서 디지털의료기기 GMP를 8가지 유형군으로 구분함
← 좌우 스크롤이 가능합니다. →
| 디지털의료기기소프트웨어 | 의료기기 하드웨어 | |
|---|---|---|
|
1. 기계 | 4. 치과재료 |
| 2. 기구 | 5. 체외진단의료기기 기계 | |
| 3. 용품 | 6. 체외진단의료기기 시약 | |
심사구분
- 최초심사 : 제조 또는 수입 디지털의료기기가 제조 및 품질관리기준에 적합함을 인정받기 위해 최초로 받는 심사
- 정기심사 : 최초 심사 후 3년 주기로 실시하는 사후 관리 심사 (유효기간 만료일 90일 이전에 신청하여야 함)
- 변경심사 : 인공지능 및 머신러닝(AI/ML) 기능 추가 등 변경사항이 발생할 때 받는 심사
- 대체심사 : 최초·정기·변경심사를 갈음하여 받는 심사
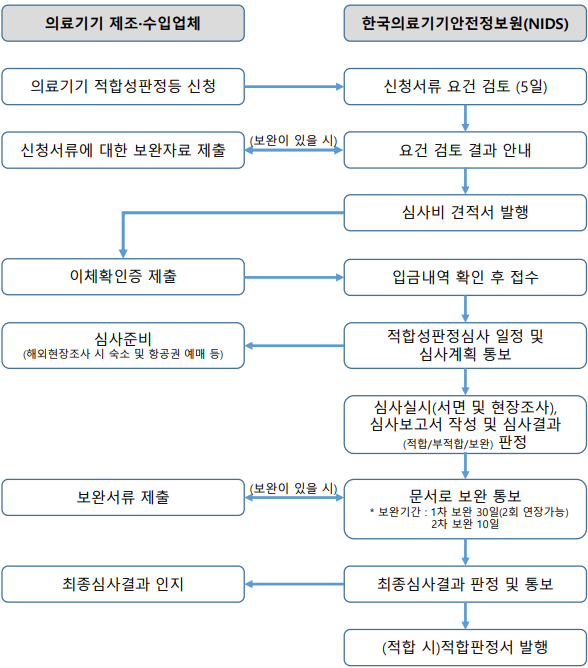
디지털의료기기 GMP 절차
구비서류
| 분류 | 내용 |
|---|---|
| 디지털의료기기소프트웨어 | 디지털의료기기소프트웨어 품질관리기준 신청서 (디지털의료제품법 시행규칙 [별지 제29호서식]) |
| 디지털의료기기 적합판정등 심사신청서 (규정 [별지 제1호서식]) | |
| 품질관리기준 적합판정 대상 디지털의료기기소프트웨어에 대한 정보 | |
| 제조업자 및 제조원의 시설·기구 및 장비에 대한 정보 | |
| 품질관리기준에 따른 조직도 및 품질매뉴얼 | |
| 품질관리기준에 따른 문서관리규정 및 문서 목록 | |
| 대표 제품의 완제품 시험 관련 절차서 및 시험성적서 | |
| 공정도, 구매·위탁 절차서, 공급업체명 및 업무 범위 | |
| 제품표준서 및 전자적 침해행위 보안 관련 절차서 | |
| 의료기기 하드웨어 | 디지털의료기기소프트웨어 품질관리기준 신청서 (디지털의료제품법 시행규칙 [별지 제29호서식]) |
| 디지털의료기기 적합판정등 심사신청서 (규정 [별지 제1호서식]) | |
| 제조(수입)업 (조건부)허가증 사본(최초심사 또는 임상시험용의 경우 제외) | |
| 제조소 개조 및 조직도, 종업원 수, 제조되는 제품 등 | |
| 각 제조소의 시설현황 및 모니터링 측정장비 관련 절차서 | |
| 제조소의 품질매뉴얼 | |
| 완제품 시험 관련 절차서 및 시험성적서 | |
| 구매·위탁 절차서, 주요 공급업체명 및 업무범위 | |
| 제품표준서 및 멸균 유효성 확인 절차서 | |
| 별표 2 기준 점검표 | |
| 별표 2 기준 적합선언문 | |
| 별표 3 및 별표 4에 따른 대표 제품의 공정도 | |
| 대체심사 | 공정도 및 유형군별 대표 제품의 서류 |
| 적합인정서 등 관련 자료 |
심사 기간
통상적으로 현장조사 기간은 다음과 같이 적용됨
| 조항 | [별표 2] | [별표 3] | [별표 4] |
|---|---|---|---|
| 일수 | 3일 | 2일 | 1일 |
※ 독립형 디지털의료기기소프트웨어의 경우 국내 제조업 GMP 심사([별표 2])는 2일부터 적용되며, 신청업체의 종사자 수, 위·수탁여부 등에 따라 심사 기간 변동될 수 있음
신청 방법
식품의약품안전처 의료기기전자민원시스템(https://emedi.mfds.go.kr)를 통한 인터넷 접수
- 경로 : 민원신청 → 디지털의료기기 민원신청 → 디지털의료기기 품질관리기준









