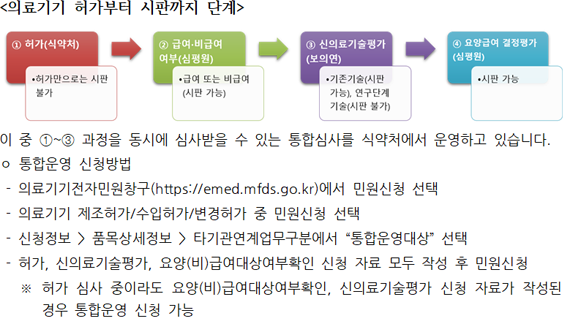
의료기기 허가부터 시판까지 단계 알림

체외진단의료기기 경미한변경 안내문

※ 신청하고자 하는 변경사항에 맞는 ‘보고구분’을 선택하여 신청해주시기 바랍니다.
분기보고 : 보고일자 기준으로 전 분기에 발생했던 변기 내용을 다음 분기 첫 일부터 말일 이내에 보고

분기내 보고(즉시보고)
- 제품명 변경, 추가, 삭제
- 모델명 변경, 추가, 삭제
- 상호변경에 따른 제조원 명칭 변경
- 수입의료기기의 제조의뢰자 소재지 변경
- 경미한변경에 해당하는 부분품 변경 또는 추가
- 부작용 등 안전성 정보에 따른 사용 시 주의사항 변경
의료기기 경미한변경 안내문
※ 신청하고자 하는 변경사항이 명확하게 아래와 같은 변경사항이 아니라면
’21번 의료기기변경허가‘로 신청해주시기 바랍니다.
- 1. 수출용 의료기기의 변경사항(사용목적, 제조소 소재지 변경 및 추가, 양도·양수 변경은 제외)
- 2. 『의료기기 허가 · 신고 · 심사 등에 관한 규정』 [별표 3]경미한 변경사항
- 3. 소프트웨어 업데이트에 관한 변경사항(업그레이드*, 제조소 소재지 변경 및 추가, 양도·양수 변경은 제외)
* 소프트웨어 업그레이드
- 사용목적 또는 이와 관련된 주요 기능의 변경
- 생체신호 또는 의료영상과 같은 분석대상이나 분석기법 등 분석알고리즘의 변경
- 의료기기 소프트웨어 개발언어 또는 운영환경의 변경
- 사이버 보안에 영향을 미치는 통신 기능 등의 변경









