의료기기 자료관
허가 절차
- 홈으로 이동
- 의료기기 자료관
- 허가정보
- 허가 절차
허가절차
「의료기기법」 제6조제2항 및 같은 법 시행규칙 제5조제1항, 「의료기기 허가・심사・신고 등에 관한 규정」에 따라 신청사항 및 제출 자료를 심사하여 안전성과 성능이 적합한 경우 의료기기를 허가
법적 근거
「의료기기법」 제6조(제조업의 허가 등)·제15조(수입업허가 등)·제44조(권한의 위임 및 위탁)
「의료기기법 시행규칙」제4조(제조허가·제조인증 및 제조신고의 대상)·제5조(제조허가의 절차)·제6조(제조인증의 절차)·제7조(제조신고의 절차)·제8조(시설과 제조 및 품질관리체계의 기준)·제9조(기술문서 등의 심사)·제30조(수입허가 신청 등)·제31조(품질검사를 위한 시설과 제조 및 품질관리체계의 기준)·제34조(준용)
추진 경과
「의료기기법」 제정(‘03.5.29)
「의료제품 업무처리 내부위임에 관한 규정」제정(식약처 훈령 제61호)에 따라 평가원(의료기기심사부)으로 허가업무 위임(‘14.5.19)
「의료기기법」제44조제2항 개정에 따라 한국의료기기안전정보원으로 1등급 신고, 2등급 인증업무 위탁(‘15.7.27)
의료제품 분야의 허가‧심사 업무의 효율적 추진을 위한 전담 조직으로 식약처에 융복합혁신제품지원단 설치 및 운영(‘19.3.4)
허가‧심사 수요 증대 및 정책과의 연계성 강화를 위한 허가전담 조직으로 식약처 첨단제품허가담당관 정식직제화(‘20.8.31)
의료기기 허가·인증·신고 대상
품목류별 제조·수입인증 또는 제조·수입신고
- 인체에 미치는 잠재적 위해성이 낮아 고장이나 이상이 발생하더라도 생명이나 건강에 위해를 줄 우려가 거의 없는 의료기기로서 식약처장이 정하여 고시하는 의료기기(「의료기기 허가·신고·심사 등에 관한 규정」(식약처 고시)[별표1])
- · 인증 : 2등급 중 ‘혈액냉장고’ 등 18개 품목의 의료기기
- · 신고 : 1등급 중 ‘재사용가능수동식의료용칼’ 등 53개 품목의 의료기기
품목별 제조·수입허가, 제조·수입인증 또는 제조·수입신고
- 품목류별 제조·수입인증 또는 제조·수입신고 대상 외 의료기기
- · 허가
① 3·4등급 의료기기② 1·2등급 중 이미 허가 또는 인증을 받거나 신고한 의료기기와 구조·원리·성능·사용목적·사용방법 등이 본질적으로 동등하지 아니한 의료기기③ 2등급 중 인증대상에서 제외한 의료기기(의약품 또는 의약외품과 조합되거나 복합 구성된 의료기기, 유헬스케어 의료기기, 호흡감시기, 매일착용 하드(소프트) 콘택트렌즈, 의료기기 허가·신의료기술평가 통합운영 대상 의료기기) - · 인증 : 위해도가 낮은 2등급 의료기기(단, 「의료기기 위탁 인증·신고의 대상 및 범위 등에 관한 지침」(식약처 고시)에서 정한 인증 제외대상은 제외)
- · 신고 : 1등급 의료기기
의료기기 등급별 허가·인증·신고 분류
| 구분 | 신고 | 인증 | 허가 |
|---|---|---|---|
| 1등급 | O | - | O ※ 이미 신고한 의료기기와 구조 등이 본질적으로 동등하지 아니한 의료기기 |
| 2등급 | - | O | O ※ 이미 신고한 의료기기와 구조 등이 본질적으로 동등하지 아니한 의료기기 ※ 호흡감시기 등 인증대상에서 제외한 2등급 의료기기 |
| 3등급 | - | - | O |
| 4등급 | - | - | O |
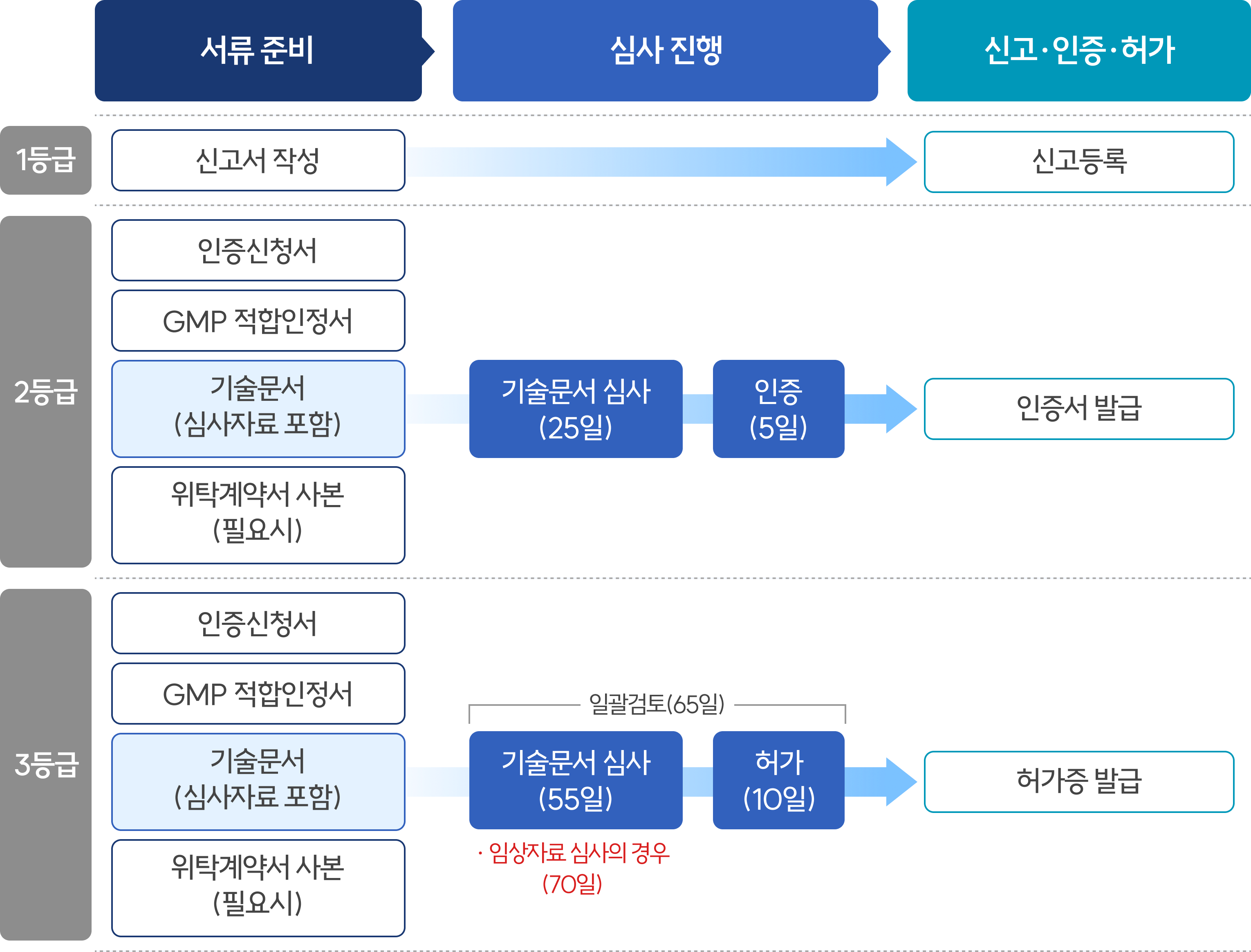
허가·심사 절차
의료기기 허가는 허가・인증・신고로 구분되며, 허가는 식약처에서 처리하고, 인증・신고는 한국의료기기안전정보원에서 처리
- 민원 처리기간은 기술문서 심사기간을 포함하여 허가 65일(임상 80일), 인증 30일, 신고는 즉시 처리하고 있음
- · 의료기기 허가 신청 시, 제출자료
① 의료기기 허가 신청서② 의료기기 제조 및 품질관리기준(GMP) 적합인정서③ 기술문서 등 심사자료 또는 기술문서심사 결과 통지서④ 위탁계약서 사본(제조공정 또는 품질관리를 위한 시험을 위탁한 경우)
의료기기 기술문서 등 심사는 제조·수입허가·인증(변경허가·인증 포함)을 받고자 하는 의료기기를 대상*으로 함
- 등급별로 심사기관이 다르며, 2등급**은 식약처장으로부터 지정받은 기술문서심사기관이, 3·4등급은 식약처에서 심사
- * 제외대상: 수출용의료기기, 동등공고제품, 동일제품, 경미한 변경대상 의료기기
- ** 다만, 2등급 중 ❶이미 허가 또는 인증을 받은 의료기기와 구조·원리·성능·사용목적 및 사용방법 등이 본질적으로 동등하지 않거나 임상시험에 관한 자료의 제출이 필요한 의료기기, ❷유헬스케어 의료기기, ❸신규 품목 지정 필요 의료기기, ❹의약품 또는 의약외품과 조합되거나 복합구성된 의료기기는 제외
의료기기 등급별 허가 및 심사 주체
← 좌우 스크롤이 가능합니다. →
| 구분 | 1등급 | 2등급 | 3등급 | 4등급 |
|---|---|---|---|---|
| 주체 | 한국의료기기안전정보원 | 식품의약품안전처 | ||
| 인허가명 (처리기관) |
신고 (즉시) |
인증 (5일) |
허가 (10일) |
허가 (10일) |
| 기술문서 (처리기관) |
- | 8개 위탁기관* | 의료기기심사부 (55일, 임상 70일) |
의료기기심사부 (55일, 임상 70일) |
- * 한국산업기술시험원, 한국기계전기전자시험연구원, 한국화학융합시험연구원, 한국건설생활환경시험연구원, 한국에스지에스(주), 대구경북첨단의료산업진흥재단, 연세대의료원치과의료기기시험평가센터, 한국의료기기안전정보원
의료기기 허가·심사 절차
허가 현황(수출용 포함, 조건부 제외)
최근 5년간 의료기기 허가・인증・신고 현황
← 좌우 스크롤이 가능합니다. →
| 구분 | 신고 | 인증 | 허가 | 총합계 | |||
|---|---|---|---|---|---|---|---|
| 제조 | 수입 | 제조 | 수입 | 제조 | 수입 | ||
| 2016년 | 1,538 | 3,482 | 941 | 705 | 988 | 582 | 8,236 |
| 2017년 | 1,462 | 3,654 | 982 | 795 | 924 | 491 | 8,308 |
| 2018년 | 1,740 | 2,966 | 1,049 | 852 | 811 | 327 | 7,745 |
| 2019년 | 1,763 | 3,448 | 1,038 | 859 | 804 | 357 | 8,269 |
| 2020년 | 1,963 | 2,906 | 1,127 | 825 | 1,132 | 230 | 8,183 |
| 총합계 | 8,466 | 16,456 | 5,137 | 4,036 | 4,659 | 1,987 | 40,741 |
| 24,922 | 9,173 | 6,646 | |||||
최근 5년간 등급별 허가현황
← 좌우 스크롤이 가능합니다. →
| 구분 | 1등급 | 2등급 | 3등급 | 4등급 | 총합계 | ||||
|---|---|---|---|---|---|---|---|---|---|
| 제조 | 수입 | 제조 | 수입 | 제조 | 수입 | 제조 | 수입 | ||
| 2016년 | 2 | 0 | 198 | 207 | 542 | 285 | 246 | 90 | 1,570 |
| 2017년 | 0 | 1 | 80 | 100 | 551 | 287 | 293 | 103 | 1,415 |
| 2018년 | 0 | 0 | 74 | 46 | 539 | 221 | 198 | 60 | 1,138 |
| 2019년 | 0 | 1 | 57 | 39 | 480 | 240 | 267 | 77 | 1,161 |
| 2020년 | 4 | 4 | 69 | 45 | 845 | 113 | 214 | 68 | 1,362 |
| 총합계 | 6 | 6 | 478 | 437 | 2,957 | 1,146 | 1,218 | 398 | 6,646 |






















